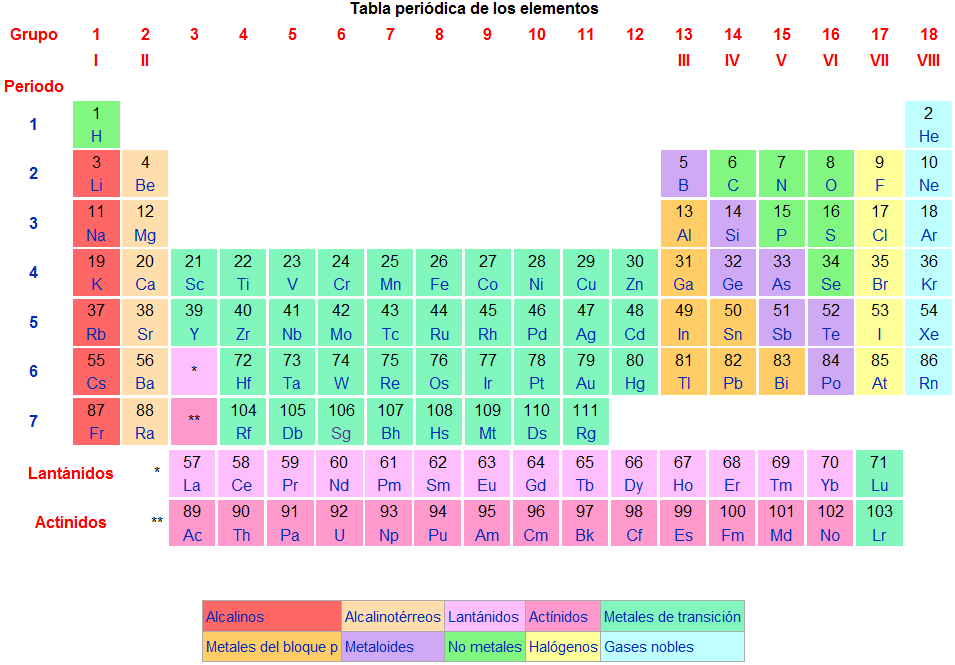
Los elementos químicos de la tabla periódica se clasifican en cinco grandes grupos: metales, ametales (o no metales), semimetales, gases nobles e hidrógeno.
Esta división puede verse distinguida por variedad de colores en la tabla periódica que ilustra esta información.
Metales: los metales constituyen la mayor parte de los elementos existentes (dos tercios). Ellos están representados en la tabla anterior y coinciden con los 87 elementos.
A temperatura ambiente ellos son duros, sólidos, a salvedad del mercurio (Hg), que es líquido. Son conductores de calor y electricidad. El metal es caracterizado también por su maleabilidad (capacidad de ser moldeado) y por su ductilidad (capacidad de formar hilos, como, por ejemplo, los hilos de cobre, usados en hilos de transmisión de energía eléctrica). Además, presenta un brillo metálico característico.
Los elementos de las familias o grupos 1 (IA) y 2 (IIA), se llaman, respectivamente, metales alcalinos (del árabe álcali, ceniza de plantas) y metales alcalinotérreos (con el sentido de existir en la tierra).
El grupo de metales puede ser subdividido en tres partes:
Metales representativos: son 32 elementos pertenecientes a las columnas 3 a 12 o 3B, 4B, 5B, 6B, 7B, 8B, 1B y 2B*.
Metales de transición interna: son 26 elementos de la serie de los lantánidos y actínidos.
10 metales no encajan en ninguno de estos grupos.
Ametales o no metales: son 11 elementos indicados en la tabla superior con el color verde: carbono (C), nitrógeno (N), fósforo (P), oxígeno (O), azufre (S), selenio (Se), flúor (F), cloro (Cl), bromo (Br), yodo (I) y ástato (At).
Estos elementos tienen características opuestas, es decir, los metales no son buenos conductores del calor y electricidad. Por el contrario, la mayoría funciona como aislante, exceptuando el grafito que es buen conductor de calor y electricidad. Ellos no poseen brillo característico (con excepción del yodo y del grafito ya mencionado) y se fragmentan.
Semimetales: esta nomenclatura se encuentra en desuso pues la IUPAC (Unión Internacional de Química Pura y Aplicada) no reconoce más esa clasificación desde 1986. Mientras, en muchas tablas siete elementos todavía son clasificados de esa forma, pues poseen características intermediarias a las de los metales y ametales.
En las tablas periódicas en que esa clasificación no es más utilizada, los elementos germanio (Ge), antimonio (Sb) y polonio (Po) se consideran metales. Y los elementos boro (B), silicio (Si), arsénico (As) y telurio (Te) son no metales.
El silicio es uno de los más importantes, porque es a partir de sus láminas extremamente finas que se fabrican los chips.
Gases nobles: representan los elementos de la familia 18 (0 o VIII A), que son, respectivamente: helio, neón, argón, criptón, xenón y radón. Estos elementos son gaseosos a temperatura ambiente y generalmente se encuentran en la naturaleza en su forma aislada, pues así son más estables. Además, ellos no forman compuestos con otros elementos espontáneamente.
Hidrógeno: este elemento no encaja en ningún grupo de la tabla periódica. En algunas tablas aparece en la familia de los alcalinos, por poseer un electrón en su capa de valencia. De hecho, esa es su única capa electrónica. Sin embargo, sus características son semejantes a los elementos de esa familia.
El hidrógeno es el elemento más abundante en el universo, porque puede combinarse con los metales, ametales y semimetales. Es un gas muy inflamable, a temperatura ambiente, y es típicamente encontrado en las capas altas de la atmósfera o combinado con otros elementos. El hidrógeno licuado se utiliza como combustible para cohetes.
Actualmente es recomendado que los nombres de los grupos o familias sean indicados por los números de 1 a 18 y no por los números romanos acompañados de las letras A y B.