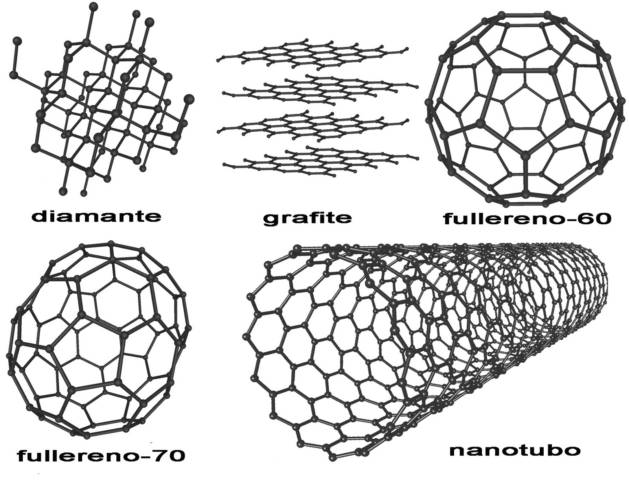
Estructuras moleculares de los alótropos del carbono
El hecho de que grafito y el diamante tengan el mismo elemento (carbono) como constituyente puede causar dudas como: ¿por qué los materiales que poseen la misma constitución atómica son tan diferentes en consistencia?
Mientras que el grafito provoca suaves trazos en el papel, el diamante perfora dientes. Las brocas usadas por los dentistas son diamantadas, es decir, son recubiertas por diamantes. Para tenerse una idea de la dureza del diamante, él es utilizado para cortar bloques de granito.
La alotropía es el concepto que explica por qué los átomos de carbono pueden unirse de varias formas diferentes, formando numerosas sustancias.
El diamante y el grafito son alótropos del carbono y se diferencian por la disposición geométrica:
- El grafito del que hablamos es aquel sólido suave y cenizo presente en la punta del lápiz, que posee una densidad igual a 2,25 g/cm3.
- El diamante es transparente (con brillo característico) y duro. Su densidad es 3,51 g/cm3.
Las dos formas son sustancias simples formadas sólo por carbono, pero que debido a la reorganización de los átomos se convierten en sustancias con propiedades completamente diferentes. Es lo que llamamos de reordenamiento de los átomos.