En la naturaleza hay muchas moléculas no polares, es decir, donde no hay ninguna diferencia en la electronegatividad entre los átomos y que no ocurre desplazamiento de la carga de la molécula, pero que todavía se presentan en el estado líquido y sólido.
¿Cómo explicar la atracción entre estas moléculas en el estado sólido o líquido? Si no hubiese interacción entre ellas, tales sustancias solamente existirían en el estado gaseoso, pero nosotros sabemos que eso no es cierto. Por ejemplo, el yodo (I2) y el dióxido de carbono (CO2) pueden presentarse en el estado sólido, siendo que este último es conocido en ese estado como hielo seco.
Las respuestas a estas y otras preguntas que implican las interacciones entre las moléculas comenzaron a ser reveladas en 1873 por Johannes Diederik van der Waals (1837-1923). Este científico holandés determinó las fuerzas que se establecen entre las moléculas y, en su honor, vinieron ser conocidos como fuerzas de van der Waals.
Johannes Diederik van der Waals (1837-1923). Las tres principales fuerzas intermoleculares son: enlace de hidrógeno, dipolo permanente y dipolo inducido. Este último es el más débil de los tres y es el único que sucede entre moléculas apolares.
Es llamado también por los siguientes nombres: nteracción dipolo inducido – dipolo inducido, dipolo instantáneo – dipolo inducido, fuerzas de dispersión de London (en homenaje al físico alemán Fritz Wolfgang London, que relacionó esa fuerza intermolecular al movimiento de los electrones) o simplemente, fuerzas de London.
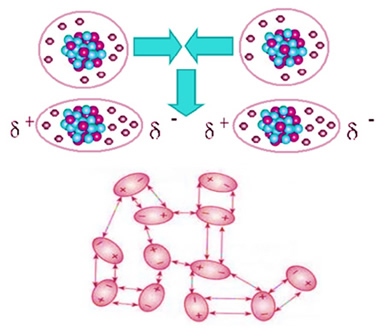
Esta interacción se produce de la siguiente manera: cuando dos moléculas apolares o dos átomos de un gas noble se aproximan, los electrones de las electrosferas de los átomos se repelen provocando un movimiento de los electrones, que se acumulan en una única región. De ese modo, se crea un dipolo en la molécula o átomo, pues una región queda con acumulación de electrones y carga negativa, y otra región queda con deficiencia de electrones y carga positiva. Veamos como eso sucede a continuación:
Dos átomos que estaban inicialmente con una distribución uniforme de los electrones se aproximan y ocurre la formación de un dipolo inducido.
Puesto que esta fuerza es poco intensa, el yodo y el hielo seco tienen la capacidad de la sublimación, es decir, pasar directamente del estado sólido al gaseoso.
El yodo y el hielo seco se subliman porque sus fuerzas de atracción intermoleculares son débiles.
En la naturaleza hay muchas manifestaciones de este tipo de fuerza en acción. Uno de los ejemplos más espectaculares es la impresionante capacidad de la lagartija (también conocida como Gecko), tiende a andar sobre superficies muy lisas, como el vidrio e incluso el techo sin caerse.
Esto es porque cada dedo de la lagartija contiene saliencias con miles de cerdas bien finas, como un pelo, y cada una de esas cerdas contiene miles de filamentos microscópicos. Las moléculas de las cerdas adhieren a las de la superficie por causa de fuerzas de atracción de dipolo inducido.
Pero, visto que esas fuerzas son bien débiles, ¿la fuerza de la gravedad no debería solaparse a ellas? Sucede que esa fuerza multiplicada por los miles de cerdas de las patas de la lagartija produce una atracción suficiente para aguantar el peso de ese animal. Nuestras manos no poseen esos filamentos microscópicos, por eso, no conseguimos subir una pared.
Además, las interacciones de dipolo – dipolo inducido pueden ocurrir también entre moléculas de sustancias diferentes, siendo una apolar y otra polar. Por ejemplo, el gas oxígeno es apolar y la molécula de agua es polar. Cuando el oxígeno entra en contacto con el agua, la parte negativa de la molécula de agua retira los electrones de la nube electrónica del oxígeno, creando un dipolo inducido en la molécula de oxígeno. Es por eso que esas moléculas interactúan entre sí, atrayéndose mutuamente, y eso hace posible disolver gas oxígeno en el agua.